Traitement de la DMLA : l'Autorité sanctionne 3 laboratoires pour des pratiques abusives
L’Autorité sanctionne les 3 laboratoires Novartis, Roche et Genentech à hauteur de 444 millions d’euros pour des pratiques abusives visant à préserver les ventes du médicament Lucentis pour le traitement de la DMLA au détriment d’Avastin (spécialité concurrente 30 fois moins chère).
La décision de l’Autorité de la concurrence n° 20-D-11 du 9 septembre 2020 ayant sanctionné les sociétés Novartis Pharma SAS, Novartis Groupe France SA, Novartis AG, Roche SAS, Genentech, Inc, et Roche Holding AG a été réformée par un arrêt de la cour d’appel de Paris, en date du 16 février 2023, qui a jugé qu’aucune pratique anticoncurrentielle n’était établie à leur encontre. Cet arrêt a été annulé par la Cour de cassation (arrêt du 25 juin 2025).
L'essentiel
La dégénérescence maculaire liée à l’âge (DMLA), est la principale cause de malvoyance chez les sujets de plus de 50 ans dans les pays industrialisés. Elle entraîne une altération sévère de la vision centrale, qui se présente notamment sous la forme de taches sombres perçues par le patient au milieu de sa vision.
Le laboratoire Genentech a développé un médicament, le Lucentis, traitant la DMLA. Il a aussi développé un autre médicament, un anticancéreux, l’Avastin. Les médecins se sont rendu compte que l’Avastin avait des effets positifs pour les malades atteints de DMLA, ce qui a conduit à un développement de son usage, hors autorisation de mise sur le marché (AMM), pour traiter cette maladie, alors que par ailleurs l’Avastin avait un coût 30 fois moins élevé que le Lucentis.
- Lucentis : 1161 €/injection
- Avastin : 30/40 €/ injection
A la suite du développement de l’utilisation hors AMM de l’Avastin dans le traitement de la DMLA, les autorités publiques de nombreux pays ont engagé des projets de recherche visant à tester l’efficacité et les éventuels effets secondaires associés à la prescription d’Avastin pour le traitement de la DMLA.
C’est dans ce contexte que les laboratoires Genentech, Novartis et Roche ont mis en œuvre un ensemble de comportements (abus de position dominante collective) visant à préserver la position et le prix du Lucentis, en freinant l’utilisation hors AMM de l’anticancéreux Avastin.
L’abus de position dominante collective
Un abus de position dominante collective est une notion de droit de la concurrence qui appréhende une position dominante, non pas à partir de la position d’un seul acteur mais à partir du pouvoir de marché d’entreprises ayant entre elles des liens étroits.
L’Autorité a estimé que les 3 laboratoires - Novartis, Roche et Genentech – doivent être regardés comme formant une « entité collective » au sens du droit de la concurrence, compte tenu des liens capitalistiques croisés et des liens contractuels qui existent entre eux : en particulier les contrats de licence liant d’une part, Genentech et Novartis pour la commercialisation du Lucentis, et, d’autre part, Genentech et Roche pour la commercialisation d’Avastin. Compte tenu des différences de coût de traitement entre les deux spécialités, toute utilisation d’Avastin à la place de Lucentis était susceptible d’entraîner un manque à gagner significatif pour chacun des trois laboratoires concernés :
- pour Novartis, d’abord, qui reçoit, en tant que licencié, le produit des ventes de Lucentis sur le marché concerné,
- pour Genentech ensuite, qui perçoit, en tant que donneur de licence, les redevances des ventes de Lucentis sur le marché concerné,
- pour Roche enfin, qui, en tant qu’actionnaire principal, puis unique depuis mars 2009, de Genentech, profite des bénéfices de ce laboratoire américain
Novartis a dénigré l’Avastin
Novartis a cherché à faire échec aux initiatives des médecins ophtalmologistes qui, dans le cadre de leur liberté de prescription, décidaient de prescrire Avastin « hors AMM » en ophtalmologie. Il a diffusé un discours dénigrant, qui exagérait, de manière injustifiée, les risques liés à l’utilisation « hors AMM » du médicament anticancéreux Avastin pour le traitement de la DMLA, et plus généralement en ophtalmologie, en comparaison avec la sécurité et la tolérance de Lucentis pour un même usage.
Cette pratique a eu pour effet de limiter les prescriptions d’Avastin « hors AMM » pour le traitement de la DMLA et, plus généralement en ophtalmologie. Indirectement, elle a également eu pour conséquence de maintenir Lucentis à un prix supra-concurrentiel et particulièrement élevé, et d’aboutir à la fixation du prix d’Eylea (spécialité concurrente arrivée sur le marché en novembre 2013) à un niveau artificiellement élevé.
Discours alarmiste et trompeur auprès des autorités publiques
Novartis, Roche et Genentech ont par ailleurs été sanctionnés pour avoir mis en œuvre un ensemble de comportements de blocage et pour avoir diffusé un discours alarmant, et parfois trompeur, auprès des autorités publiques sur les risques liés à l’utilisation d’Avastin pour le traitement de la DMLA. Ces pratiques visaient à bloquer ou ralentir, de façon indue, les initiatives des pouvoirs publics visant à sécuriser son usage hors AMM pour le traitement de la DMLA.
Les pratiques en cause sont particulièrement graves, car elles sont intervenues dans le secteur de la santé, où la concurrence est limitée, et plus spécifiquement, dans un contexte de débat public sur l’impact sur les finances sociales du prix extrêmement élevé du Lucentis - médicament remboursé à 100 % par la Sécurité sociale - alors qu’il existait un médicament, Avastin, nettement moins cher, susceptible d’être utilisé en ophtalmologie.
Au total, l’Autorité a prononcé une sanction à hauteur de 444 millions d’euros qui se répartit comme suit :
| Laboratoire | Sanction |
|---|---|
| Novartis | 385 103 250 € |
| Roche/Genentech | 59 748 726 € |
| Total | 444 851 976 € |
La dégénerescence maculaire liée à l’âge (DMLA) et ses traitements
Un enjeu de santé publique et financier
La DMLA, maladie de la rétine provoquée par une dégénérescence de la macula, partie centrale de la rétine, est la principale cause de malvoyance chez les sujets âgés de plus de 50 ans dans les pays industrialisés. A son stade tardif, la DMLA entraîne une altération sévère de la vision centrale, qui se présente notamment sous la forme de taches sombres perçues par le patient au milieu de sa vision oculaire.
Cette pathologie a fait l’objet d’un grand nombre d’études scientifiques, en raison tant de l’enjeu de santé publique que de l’enjeu financier majeur pour les systèmes de santé, les traitements disponibles étant particulièrement onéreux.
Les traitements
Découverts par le laboratoire américain Genentech, les médicaments appartenant à la classe des anti-VEGF (facteur de croissance de l'endothélium vasculaire) ont été conçus à l’origine pour traiter certains types de cancers, en inhibant le développement vasculaire des tumeurs cancéreuses. Par la suite, les anti-VEGF ont également permis de traiter certains troubles ophtalmologiques liés à une vascularisation excessive de l’œil, comme notamment la DMLA, par le biais d’injections intravitréennes. A l’issue de ses recherches sur l’inhibition du VEGF, le laboratoire Genentech a développé deux molécules : le bevacizumab, (dont le nom commercial est Avastin, et le ranibizumab,dont le nom commercial est Lucentis :
- Avastin
Le laboratoire Genentech assure la commercialisation du médicament Avastin aux Etats-Unis. Pour le reste du monde, le laboratoire a accordé au laboratoire Roche une licence pour l’exploitation et la commercialisation d’Avastin.
En France, Avastin a commencé à être commercialisé en 2005 par Roche, conformément à une autorisation de mise sur le marché (AMM1) européenne accordée en janvier 2005, pour le traitement de certains types de cancer.
- Lucentis
Le laboratoire Genentech assure la commercialisation du médicament Lucentis aux Etats-Unis. Pour le reste du monde, le laboratoire a accordé une licence pour l’exploitation et la commercialisation de Lucentis au laboratoire Novartis.
En France, Lucentis a ainsi commencé à être commercialisé en 2007 par Novartis pour le traitement de la DMLA2, à la suite de la délivrance d’une AMM européenne délivrée en 2007. Ses indications ont ensuite été étendues en 2011 au traitement d’autres pathologies oculaires3.
Au moment de son lancement, en 2007, le prix de Lucentis était de 1 161 euros par dose injectée. Il a ensuite fait l’objet de plusieurs baisses, entre 2008 et 2013, pour atteindre 789,50 euros par dose. Dans un document relatif aux dépenses des médicaments de ville en 2012, l’Assurance maladie précisait que Lucentis était devenu le premier médicament de ville remboursé par la Sécurité sociale en France, avec près de 390 millions d’euros remboursés et une progression très forte d’environ 30 % par rapport à l’année précédente.
L’utilisation « hors AMM » d’Avastin par les praticiens ophtalmologistes
Après les premières administrations d’Avastin en oncologie, certains médecins ont observé que l’état de santé des patients atteints à la fois d’une tumeur cancéreuse et de DMLA s’améliorait également en ce qui concerne cette dernière pathologie.
La pratique consistant à utiliser Avastin pour le traitement de la DMLA (ainsi que pour d’autres pathologies oculaires) s’est alors assez fortement développée en France et dans le monde (Europe, États-Unis) et ce, même après l’admission de Lucentis au remboursement. Avastin étant un médicament de réserve hospitalière, cet usage intervenait essentiellement à l’hôpital.
Lorsque les médecins prescrivent Avastin en ophtalmologie, ils n’utilisent qu’un seul flacon d’Avastin pour effectuer plusieurs injections, ramenant le coût unitaire de l’injection à environ 30/40 euros, à comparer à un coût d’injection du Lucentis de 1161 euros. A titre indicatif, en 2010, le prix du flacon entier d’Avastin était de 348,10 euros HT.
Le laboratoire Roche n’ayant jamais souhaité demander une AMM pour Avastin dans le domaine ophtalmique, cette utilisation d’Avastin intervenait « hors AMM », dans le cadre du principe de liberté de prescription reconnue à tout médecin.
Les initiatives des pouvoirs publics pour sécuriser l’utilisation d’Avastin
Confrontées à la persistance d’un usage hors AMM d’Avastin, les autorités publiques de nombreux pays ont décidé d’engager différents projets de recherche, qui visaient à tester l’efficacité et les éventuels effets secondaires associés à la prescription d’Avastin pour le traitement de la DMLA, Parmi ces études, on peut notamment citer les études CATT réalisées en 2011 et 2012 (Etats-Unis) et IVAN, en 2012 et 2013 (Royaume-Uni).
En France, des discussions sur l’usage hors AMM d’Avastin ont débuté dès 2006, et ont conduit au lancement en 2008 de l’étude GEFAL, financée par le Ministère de la Santé et par la Caisse Nationale d’Assurance Maladie. Les résultats de GEFAL, rendus publics en mai 2013, concluaient à l’équivalence d’Avastin et de Lucentis en termes d’efficacité, sans qu’aucune différence en termes de sécurité n’ait pu être identifiée.
Dans l’attente des résultats de ces différentes études, les autorités françaises, et en particulier l’ANSM4, ont adopté une position de prudence, reconnaissant l’existence de l’usage d’Avastin hors AMM pour traiter la DMLA, tout en invitant les médecins ophtalmologistes à la prudence. La situation a toutefois évolué avec l’adoption en décembre 2011 de la loi Bertrand5, qui encadrait plus fortement la prescription hors AMM, puis avec l’adoption en juillet 2012, par la direction générale de la santé (DGS), d’une instruction interdisant le reconditionnement d’Avastin pour un usage dans l’œil.
A la même époque, le législateur a engagé une réflexion pour mieux encadrer les prescriptions faites « hors AMM » en définissant un nouveau cadre juridique. Ce processus a finalement abouti à l’adoption, en 2014, d’un dispositif permettant la délivrance d’une « recommandation temporaire d’utilisation » (RTU), à partir du moment où « le prescripteur juge indispensable le recours à cette spécialité pour améliorer ou stabiliser l'état clinique de son patient » et ce même en présence d'alternative médicamenteuse appropriée disposant d'une autorisation de mise sur le marché (loi
n° 2014-892 du 8 août 2014 de financement rectificative de la sécurité sociale pour 2014 et son décret d’application du 30 décembre 2014). Ce nouveau cadre réglementaire permettait de donner un cadre à cet usage, en surmontant la circonstance qu’un laboratoire ne souhaite pas solliciter une AMM pour un médicament pourtant utilisé par les médecins pour traiter une affection. Tel était le cas de Roche pour Avastin, qui s’est constamment refusé à solliciter une AMM pour un usage en ophtalmologie. Avastin a fait l’objet d’une RTU prise par l’ANSM pour un usage en traitement de la DMLA en juin 2015.
Trois acteurs, étroitement lies dominaient le marché de la dmla : la position dominante collective de Novartis, Roche et Genentech
Les trois entreprises Genentech, Roche et Novartis sont liées par un tissu serré de liens structurels, importants et stratégiques. D’une part, Genentech est lié à Roche et Novartis par le biais de contrats de licence portant sur la commercialisation en dehors du territoire américain, respectivement, d’Avastin et de Lucentis. Les contrats liant Genentech et Novartis, d’une part, et Roche, d’autre part, prévoient un système très organisé de remontées d’informations, de forums de discussions et de comités communs de gestion.
D’autre part, Genentech, Roche et Novartis ont des liens capitalistiques croisés particulièrement significatifs :
- Roche était l’actionnaire majoritaire de Genentech jusqu’en 2009 et détient, depuis cette date, la totalité du capital du laboratoire américain.
- Novartis figure parmi les principaux actionnaires de Roche, puisqu’il détient 33,33 % des droits de vote de Roche Holding.
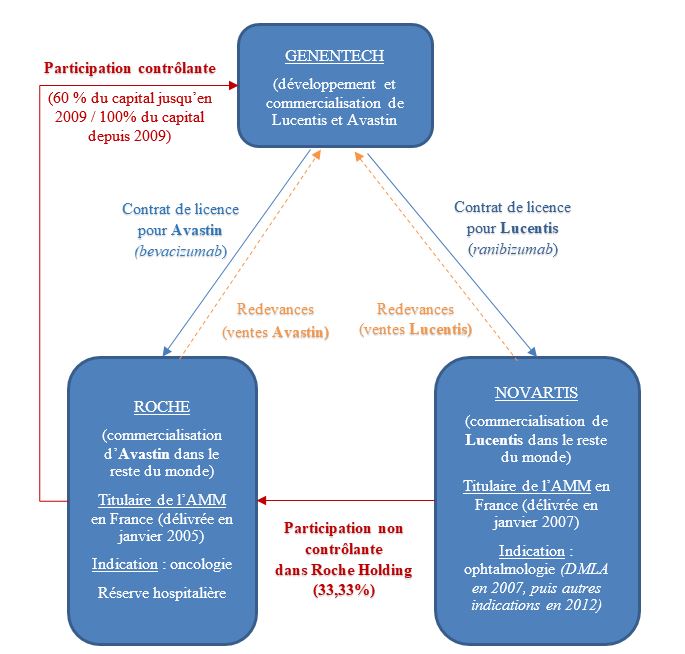
Ces liens structurels et capitalistiques ont permis à Genentech, Roche et Novartis d’adopter une ligne d’action commune sur le marché. Il existait ainsi une forte incitation financière pour les trois laboratoires à maintenir la distinction entre Avastin et Lucentis. En effet, compte tenu des différences de prix entre les deux spécialités, et de la pratique consistant à fabriquer plusieurs seringues avec un seul flacon d’Avastin, toute utilisation d’Avastin à la place de Lucentis pour une injection dans l’œil était susceptible d’entraîner un manque à gagner significatif pour chacun des trois laboratoires concernés. Et le développement d’Avastin comme alternative au Lucentis constituait une « menace » pour le maintien du prix très élevé du Lucentis. Par ailleurs, les liens structurels découlant des accords de licence entre eux leur ont permis de connaître leurs comportements respectifs, et, de ce fait, de s’assurer qu’ils adoptaient la même ligne d'action.
Compte tenu de la détention capitalistique de Genentech par Roche, les politiques commerciale et de développement de ces deux entités sont très étroitement liées, Genentech dépendant de Roche pour la fixation des orientations générales de son action. Dans ce contexte, Roche n’avait aucun intérêt à poursuivre une politique consistant à positionner Avastin sur le marché d’une façon qui ne correspondait pas aux intérêts de sa filiale Genentech.
Cette entité collective disposait d’une position dominante pour le traitement de la DMLA, qui a pris fin en 2013, avec l’arrivée sur le marché du médicament Eylea (laboratoire Bayer), qui a capté 36 % des parts de marché seulement 3 mois après son entrée sur le marché en novembre 2013.
Les pratiques sanctionnées
Grief 1 : Les pratiques de dénigrement de l’Avastin mises en œuvre par Novartis (durée : mars 2008 à novembre 2013)
Novartis a mis en œuvre une campagne de communication globale et structurée tendant à jeter le discrédit sur l’utilisation d’Avastin en ophtalmologie, en faveur de Lucentis. Cette campagne a ciblé les médecins ophtalmologistes, et en particulier les « Key Opinion leaders » (principaux leaders d’opinion), des médecins reconnus dans leur domaine, qui devaient servir de relais au discours du laboratoire. Le discours de Novartis a également été diffusé aux associations de patients et au grand public.
Les éléments du dossier montrent sans équivoque que le discours de Novartis n’était pas motivé par des considérations de santé publique, mais qu’il s’inscrivait dans le cadre d’une manœuvre anticoncurrentielle, visant à exagérer sciemment les craintes liées à la sécurité de l’utilisation d’Avastin « hors AMM » en ophtalmologie, afin de préserver la position forte de Lucentis et son prix élevé.
Le laboratoire ne s’est pas contenté d’évoquer les différences objectives entre Lucentis et Avastin, ni de rappeler fidèlement le contexte scientifique relatif à l’utilisation d’Avastin. Au contraire, Novartis a présenté à ses interlocuteurs un ensemble d’éléments de comparaison d’Avastin et Lucentis, en s’appuyant notamment sur une présentation sélective et biaisée des données scientifiques disponibles, en vue d’exagérer les risques liés à l’utilisation d’Avastin « hors AMM » pour le traitement de la DMLA et, plus généralement, en ophtalmologie :
- En premier lieu, Novartis a diffusé un discours suggérant, et parfois affirmant, qu’il existait un risque d’effets systémiques supplémentaires liés aux propriétés biologiques d’Avastin, différentes de celles de Lucentis, tout en insistant sur la prétendue garantie en termes de sécurité apportée par Lucentis.
- En deuxième lieu, Novartis a effectué une présentation sélective et biaisée des résultats des études scientifiques, comparant l’efficacité et la sécurité de l’utilisation d’Avastin et de Lucentis en ophtalmologie. En faisant ressortir certains résultats en dehors de tout contexte, ou en concentrant son discours sur les limites méthodologiques des études, tout en s’abstenant d’en présenter les conclusions générales, Novartis a procédé à une présentation parcellaire et décontextualisée des résultats des études scientifiques disponibles.
- En troisième lieu, Novartis a fait une présentation sélective des modifications opérées par l’Agence européenne du médicament sur le résumé des caractéristiques du produit (RCP) d’Avastin et de Lucentis. La communication de Novartis sur ce point suggérait que l’autorité européenne de santé avait décidé d’informer le public de l’existence d’effets indésirables systémiques qui aurait été détectés uniquement pour Avastin, alors que l’agence avait pourtant conclu qu’il ne convenait pas de faire une distinction entre les différents anti-VEGF auxquels appartient également le Lucentis. Par ailleurs, Novartis a communiqué exclusivement sur le changement de RCP d’Avastin (qui n’est pourtant pas le produit qu’elle commercialise), en s’abstenant de mentionner par ailleurs qu’elle avait dû également procéder à l’ajout de cette même mention dans le RCP de Lucentis.
- En dernier lieu, Novartis a insisté sur la responsabilité civile et pénale des professionnels de santé qui prescriraient Avastin « hors AMM ».
Cette communication a eu un impact réel et significatif sur le comportement des professionnels de santé et donc, sur la structure du marché. Elle a permis de limiter l’usage « hors AMM » d’Avastin dans de nombreux établissements hospitaliers, pour le traitement de la DMLA et, plus généralement, en ophtalmologie.
En outre, en limitant les prescriptions d’Avastin et en maintenant, de ce fait, Novartis en position de quasi-monopole, le discours du laboratoire a été de nature à empêcher qu’Avastin puisse servir de comparateur pour les autorités en charge de la fixation du prix des médicaments et que son plus faible coût justifie une baisse du prix de Lucentis.
Enfin, les pratiques ont eu un effet mécanique sur la fixation du prix d’Eylea, alternative au Lucentis, qui devait être fixé au même niveau du prix de liste de Lucentis, minoré d’une décote de 10 %.
Grief 2 : Les pratiques mises en œuvre par les 3 laboratoires vis-à-vis des pouvoirs publics (durée : Roche : avril 2008 à début novembre 2013 – Novartis : mai 2011 à début novembre 2013 – Genentech avril 2011 à début novembre 2013)
Novartis et Roche, avec l’aide de Genentech, ont mis en place un ensemble de comportements de blocage et ont diffusé un discours alarmiste et trompeur auprès des pouvoirs publics français. Ces pratiques visaient à renforcer leurs inquiétudes et à faire obstacle aux initiatives de ces derniers pour sécuriser administrativement l’utilisation d’Avastin pour le traitement de la DMLA.
Dès le mois d’avril 2008, Roche a cherché à retarder la mise en place de l’étude du Groupe d'Étude Français Avastin versus Lucentis (GEFAL) en refusant pendant plusieurs mois de fournir un certain nombre d’échantillons et d’informations indispensables à la poursuite de l’étude et qui lui avaient été réclamés par l’Agence Nationale de Sécurité du Médicament et des produits de santé et en développant un discours alarmiste sur la sécurité d’Avastin dans l’œil. Puis, à chacun de ses contacts subséquents avec l’ANSM, Roche a continué de diffuser une communication trompeuse, au travers d’une présentation biaisée des résultats des études qui commençaient à être publiés.
A partir du mois de mai 2011, Novartis a également diffusé aux pouvoirs publics un discours inquiétant, en sélectionnant certains résultats des études de comparaison et en les présentant en dehors de leur contexte. Cette communication a été diffusée à l’ensemble des parties prenantes du secteur de la santé et a donné lieu à de nombreuses réactions.
Enfin, à partir du moment où les pouvoirs publics ont annoncé envisager la possibilité d’une RTU pour Avastin, Roche et Novartis ont multiplié les initiatives et les contacts avec les représentants du gouvernement et les autorités de santé. Le discours diffusé à cette occasion opérait notamment une présentation biaisée du processus ayant conduit au changement de RCP d’Avastin, et insistait sur les risques de scandale sanitaire.
Par ailleurs, les pièces du dossier montrent que, au moins à partir du mois d’avril 2011, Genentech était systématiquement impliqué dans les échanges entre Roche et les autorités de santé et définissait le contenu du discours à tenir.
Les comportements de Roche et de Novartis ont retardé la mise en place de l’étude GEFAL et ont influencé les autorités de santé, en accroissant leur inquiétude et en les conduisant à maintenir une posture de grande prudence même après les premiers résultats favorables des études comparant Avastin et Lucentis (i.e. points d’information de l’Agence française de sécurité sanitaire et des produits de santé –AFSSAP- en 2009 et en 2011, et recommandation de la Haute Autorité de Santé -HAS- en 2012).
Le discours tenu a également directement contribué à l’interdiction par la Direction Générale de la Santé (DGS) de l’utilisation d’Avastin hors AMM en juillet 2012, et, plus généralement à retarder l’adoption de dispositions permettant d’encadrer et de sécuriser l’utilisation d’Avastin « hors AMM » en ophtalmologie.
Ce faisant, les trois laboratoires se sont assurés qu’Avastin ne puisse pas être reconnu par les autorités de santé françaises comme un comparateur pertinent de Lucentis, ce qui aurait permis aux autorités en charge de la fixation du prix des médicaments de renégocier plus tôt et de manière importante le prix de Lucentis.
1Tout médicament fabriqué industriellement et mis en vente sur un marché national ou dans l'Union européenne doit faire l'objet d'une autorisation de mise sur le marché. L’octroi d’une AMM correspond à l’autorisation de commercialisation d’une spécialité pour une ou plusieurs indication(s) thérapeutique(s), après évaluation par les autorités de santé du profil risque/bénéfice, sur la base d’études scientifiques.
2AMM européenne accordée le 22 janvier 2007.
3Comme l’œdème maculaire diabétique[3] (« OMD »), les occlusions veineuses rétiniennes[3] (plus spécifiquement, occlusion d’une branche veineuse rétinienne, « OBVR », et occlusion de la veine centrale de la rétine, « OVCR »), et de la baisse visuelle due à une néovascularisation choroïdienne (« NVC ») secondaire à une myopie forte
4Agence nationale de sécurité du médicament
5Loi n° 2011-2012 du 29 décembre 2011, relative au renforcement de la sécurité sanitaire du médicament et des produits de santé
Décision 20-D-11 du 9 septembre 2020
Contact(s)

