L’Autorité de la concurrence sanctionne Sanofi-Aventis à hauteur de 40,6 millions d’euros pour avoir mis en place une stratégie de dénigrement à l’encontre des génériques de Plavix®, l’un des médicaments les plus vendus dans le monde.

Saisie par la société Teva Santé (3ème fabricant de médicaments génériques en France), l’Autorité de la concurrence rend aujourd’hui une décision par laquelle elle sanctionne Sanofi-Aventis à hauteur de 40,6 millions d’euros pour avoir mis en place auprès des professionnels de la santé (médecins et pharmaciens d’officine) une stratégie de dénigrement à l’encontre des génériques de Plavix® afin de limiter leur entrée sur le marché et de favoriser ses propres produits, le princeps Plavix® ainsi que son auto-générique Clopidogrel Winthrop®.
Plavix® est un médicament utilisé pour la prévention des récidives des maladies cardiovasculaires graves. C’est un « blockbuster » de l’industrie pharmaceutique : 4ème médicament le plus vendu au monde, il représentait en 2008 le premier poste de remboursement de l’Assurance maladie en France (soit 625 millions d’euros).
Pour mémoire, l’Autorité de la concurrence avait rendu une première décision en 2010 sur ce dossier, dans laquelle elle avait rejeté la demande de mesures d’urgence, mais avait décidé de poursuivre l’instruction de l’affaire au fond (voir communiqué de presse et décision 10-D-16 du 18 mai 2010).
Plavix® et ses brevets
Sanofi-Aventis, filiale du groupe Sanofi et leader français de l’industrie pharmaceutique, a lancé la commercialisation de Plavix® en France en février 1999.
Plavix® est un médicament ayant pour principe actif le clopidogrel. Il a bénéficié d’une autorisation de mise sur le marché (ci-après l’« AMM ») le 15 juillet 1998. Appartenant à la classe de médicaments des antiagrégants plaquettaires, il est prescrit essentiellement en ville par des cardiologues et des généralistes. Il est utilisé dans la prévention des complications liées à l’athérothrombose, maladie entraînant une rigidité artérielle pouvant conduire à des lésions des parois artérielles et à la survenue de thromboses (caillots sanguins).
Si le brevet qui protégeait ce médicament en Europe a expiré en juillet 2008, Sanofi-Aventis a procédé au dépôt de brevets complémentaires afin de prolonger cette protection initiale :
- le type de sel utilisé dans Plavix (l’hydrogénosulfate) est resté protégé jusqu’en février 2013, par conséquent, les génériques de Plavix®, hors auto-générique, devaient impérativement utiliser un sel différent ;
- l’indication concernant le traitement du syndrome coronaire aigü (SCA) en bithérapie, au travers d’une association clopidogrel/acide acétylsalicylique (aspirine), reste également protégée par un brevet expirant en février 2017.
Les différences de sels et d’indication des génériques concurrents de Plavix®, liées uniquement à des questions de propriété intellectuelle, et non à des propriétés chimiques ou médicales particulières, n’ont aucune incidence sur la bioéquivalence et la substituabilité de ces médicaments, et ce pour la totalité des pathologies traitées par Plavix®, dont le SCA. En effet, dès lors qu’une spécialité générique est inscrite au répertoire des génériques, aucune disposition légale ou réglementaire n’empêche sa délivrance par substitution à la spécialité de référence quand bien même la spécialité générique ne présenterait pas toutes les indications de cette dernière.
A cet égard, l’Afssaps a indiqué aux services de l’Autorité que « les dossiers déposés à l’appui des demandes d’AMM pour du clopidogrel présent sous une forme autre que de l’hydrogénosulfate (sel du PLAVIX), contenaient, outre une étude de bioéquivalence à la spécialité PLAVIX, des données démontrant la sécurité et l’efficacité du sel différent (bésilate de clopidogrel ou chlorhydrate de clopidogrel). Il découle de ce qui précède que la différence de sel n’interdit pas la qualification générique d’une spécialité, et ne constitue donc pas une entrave à la substitution ».
Les premiers génériques du clopidogrel concurrents de Sanofi-Aventis ont été commercialisés au début du mois d’octobre 2009.
La pratique mise en œuvre par Sanofi-Aventis
Sanofi-Aventis a mis en œuvre une stratégie de communication globale et structurée dont l’objectif était d’influencer les médecins et les pharmaciens afin d’enrayer le mécanisme de substitution générique à deux étapes clés :
- au stade de la prescription, en obtenant des médecins qu’ils apposent sur l’ordonnance la mention « non substituable », afin de limiter le taux de générification de Plavix® ;
- au stade de la substitution elle-même, en incitant les pharmaciens à substituer Plavix® par son propre générique, Clopidogrel Winthrop®, au détriment des génériques concurrents.
Cette communication a été mise en œuvre du mois de septembre 2009 au mois de janvier 2010, soit juste au moment de l’introduction sur le marché des spécialités génériques concurrentes.
Il ressort de nombreux témoignages de médecins et de pharmaciens, mais également des remontées d’informations de la Caisse nationale d’Assurance maladie des travailleurs salariés (CNAMTS) ainsi que des éléments fournis par les groupements de pharmaciens Giropharm et Réseau Santé, que les visiteurs médicaux et délégués pharmaceutiques de Sanofi-Aventis ont diffusé à l’échelle nationale auprès des médecins et des pharmaciens un discours jetant le doute sur l’efficacité et l’innocuité des génériques concurrents de Plavix® et laissant entendre que leur responsabilité pourrait être engagée en cas de problème médical consécutif à la prescription et/ou à la délivrance de ces médicaments de substitution.
De nombreuses remontées d’information fournies par la CNAMTS montrent que les médecins ont été très sensibles à ce discours. En voici quelques exemples :
Dans la région Champagne-Ardenne : « communication antigénérique du VM [visiteur médical] auprès des pharmacies pour ne pas substituer le Plavix® sauf si le générique est Wintrop. Parfois communication agressive : substituer (en dehors de l’autogénérique Wintrop) serait un comportement « assassin ». Principal argument : la différence de sel. Communication du VM auprès des médecins pour encourager la pratique du « NS ». Des cas de décès liés à la substitution du Plavix® évoqués par le VM […] » (paragraphe 183 de la décision)
En région Nord-Pas-de-Calais, les discours relevés évoquaient notamment une « mise en danger des patients si pas de délivrance du plavix ou de l’auto générique », ou encore un « dénigrement des autres génériques en insistant sur la responsabilité du pharmacien en cas de problème chez un patient suite à la substitution » (paragraphe 186 de la décision).
Dans la région Rhône-Alpes, « les pharmacies constatent beaucoup de mentions "NS" sur les PM du clopidogrel (50% des PM, car les labos ont "terrorisé" les médecins avec leurs discours) et expriment leur mécontentement : "il faut se battre sur l’intox des labos dès qu’un Gé arrive sur le marché" » (paragraphe 247 de la décision).
Dans la région Centre, les cardiologues « rajoutent systématiquement sur leur ordonnance la mention "non substituable" ».
En région Midi-Pyrénées, « [m]édecins généralistes comme pharmaciens ne souhaitent pas prendre de risques en prescrivant ou en délivrant le générique car des questions se posent en terme d’efficacité thérapeutique des génériques commercialisés (doutes sur l’efficacité, craintes des conséquences médicales). Les médecins apposent donc la mention non substituable sur l’ordonnance, les pharmaciens ne substituent pas ou référencent l’autogénérique Winthrop » (paragraphe 500 de la décision).
Dans la région Picardie, « [l]es médecins généralistes et les cardiologues ne veulent pas prendre de risque et il est de plus en plus fréquent de voir sur les prescriptions : "PLAVIX NS" et même parfois "CLOPIDOGREL WINTROP NS" » (paragraphe 501 de la décision).
De même, un grand nombre de pharmaciens ont indiqué avoir fait le choix de commander le générique commercialisé par Sanofi-Aventis, Clopidogrel Winthrop®, afin de ne pas risquer de voir leur responsabilité engagée. Parmi les nombreux exemples recensés, voici celui d’un pharmacien situé à Pierrelatte :
« On délivre le générique des laboratoires winthrop car il est conforme de par ses sels au Plavix et nous ne voulons pas engager notre responsabilité en cas d’association avec le Kardegic. A ce sujet le personnel de l’officine a été très sensible au discours du laboratoire SANOFI sur la notion de responsabilité lors de la délivrance, en cas d’AVC ou d’infarctus par la suite (on prend des risques si on associe kardegic+ générique autre que winthrop) » (cf paragraphe 494 de la décision)
Enfin, les groupements de pharmaciens Giropharm et Réseau Santé ont été amenés à diffuser des circulaires d’informations auprès de leurs adhérents, afin de contrer « la campagne de désinformation » menée par Sanofi-Aventis et de rétablir la réalité scientifique. En voici certains extraits :
« Le sel utilisé dans le médicament n’est pas un élément critique de son efficacité » ; « L’indication absente (certaines associations avec l’Acide salicylique) n’est pas due à un potentiel manque d’efficacité des médicaments génériques, mais à une date de dépôt de brevet postérieure aux autres indications ». (paragraphe 195 de la décision).
« Sanofi a tenté de refaire avec les "sels" le coup des "Excipients à Effets Notoires". Soyons objectifs : nous comprenons les motivations de Sanofi (cf ci-dessus), pour s’opposer aux génériques de son produit phare. Mais aujourd’hui, l’Afssaps n’a pas retenu la différenciation des sels comme un argument valable pour interdire les génériques du Plavix et a inscrit la molécule au répertoire des génériques. L’influence des sels devient un non-argument dont les pharmaciens ne peuvent être dupes : aucune publication sérieuse ne justifie la position de Winthrop ». (paragraphe 197 de la décision)
Une pratique grave qui a freiné de façon substantielle le processus de substitution de Plavix® par des génériques
Le discours de Sanofi-Aventis a instillé un doute sur la qualité et la sécurité des génériques, sans se fonder sur le moindre fait avéré, puisque rien ne permet de démontrer que les génériques concurrents de Plavix® sont moins sûrs que le princeps. A cet égard, l’Autorité souligne que Sanofi-Aventis n’a formé aucun recours contre les AMM délivrées par l’Afssaps. De plus, Sanofi-Aventis était libre de transmettre aux autorités de santé toute information à sa disposition relative à la sécurité et à l’efficacité des génériques de Plavix®, dans le cadre non seulement des procédures d’AMM, mais également de la pharmacovigilance. Or, elle n’a pas, après la conclusion du débat scientifique devant les autorités de santé, fait valoir auprès de ces dernières le moindre argument permettant de faire douter de l’efficacité et de l’innocuité des génériques de Plavix®.
Ce discours trompeur a suscité de fortes inquiétudes chez les professionnels de la santé, rencontrant un écho d’autant plus important :
- que Plavix® et ses génériques sont utilisés pour soigner des pathologies cardio-vasculaires très graves (mettant en jeu le pronostic vital des patients) et que leur prise nécessitent en outre un suivi particulier dans la mesure où il peut augmenter le risque d’hémorragies ;
- que, de manière générale, les professionnels de la santé sont méfiants vis-à-vis des nouveaux médicaments ne bénéficiant pas d’un recul suffisant ;
- qu’il subsiste par ailleurs chez eux une certaine réticence vis-à-vis des médicaments génériques, laquelle s’explique notamment par leur méconnaissance des procédures d’AMM, par leur mauvaise appréhension du cadre réglementaire relatif à la substitution et par leur volonté de se prémunir contre tout risque de voir leur responsabilité civile ou pénale engagée.
Un taux de substitution anormalement bas
Les éléments du dossier montrent que le taux de substitution de Plavix® suit un profil très atypique. En effet, malgré des volumes et un chiffre d’affaires très important ainsi qu’un grand nombre de laboratoires génériqueurs présents sur le marché, ce taux, après avoir rapidement augmenté au moment de l’introduction des génériques, a connu ensuite une baisse continue pendant de très nombreux mois, ce qui n’est le cas d’aucune autre molécule comparable, comme le montre le graphique ci-dessous :
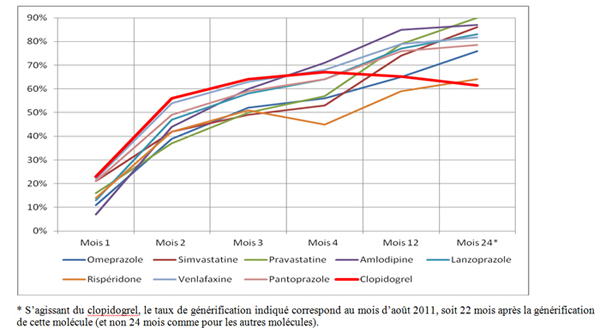
Le prix d’un générique étant sensiblement inférieur au prix du princeps de référence (la décote est généralement fixée à 55% du prix fabriquant hors taxe), une économie de plus de 200 millions d’euros était attendue en 2010 par le ministère de la Santé du fait du lancement des génériques de Plavix®, les génériques devant représenter 75 % des ventes fin 2010. Or, dans son rapport sur les résultats 2010, la Sécurité sociale relève que le « taux de pénétration effectif du clopidogrel à fin décembre 2010 [était] inférieur de 10 points à l’objectif (64,6% contre 75%) ». Si l’objectif de la Sécurité sociale ne constitue pas une référence précise et indiscutable de ce qui aurait dû prévaloir en l’absence de pratique, il fournit néanmoins un ordre de grandeur confirmant que le taux de générification de Plavix® a été significativement inférieur à ce qu’il aurait dû être.
Plavix® étant le premier poste de remboursement de l’Assurance maladie, le manque à gagner est donc substantiel pour les comptes publics. Pour la période janvier 2010 - août 2011, la CNAMTS estimait la perte liée aux économies non réalisées à 38 millions d’euros.
Une part de marché atypique pour l’auto-générique de Sanofi-Aventis au détriment des autres laboratoires génériques
La pratique en cause a permis par ailleurs à Sanofi-Aventis de bénéficier d’un taux de pénétration exceptionnel pour son propre générique, Clopidogrel Winthrop® (désormais dénommé Clopidogrel Zentiva®). Celui-ci bénéficie en effet d’une part de marché de plus de 34 % sur le segment des génériques du clopidogrel, soit une part de marché environ quatre fois supérieure à celle que Sanofi-Aventis détient habituellement sur le marché français des génériques.
Une pratique constitutive d’un abus de position dominante
Sur la base de l’ensemble de ces éléments, l’Autorité de la concurrence a donc considéré que Sanofi-Aventis avait abusé de sa position dominante sur le marché français du clopidogrel délivré en ville, et avait à ce titre enfreint l’article L.420-2 du code de commerce ainsi que l’article 102 sur Traité sur le fonctionnement de l’Union européenne. Les pratiques relevées sont particulièrement graves et justifient la sanction de 40,6 millions d’euros infligée à cette entreprise.
13-D-11 du 14 mai 2013
Contact(s)
